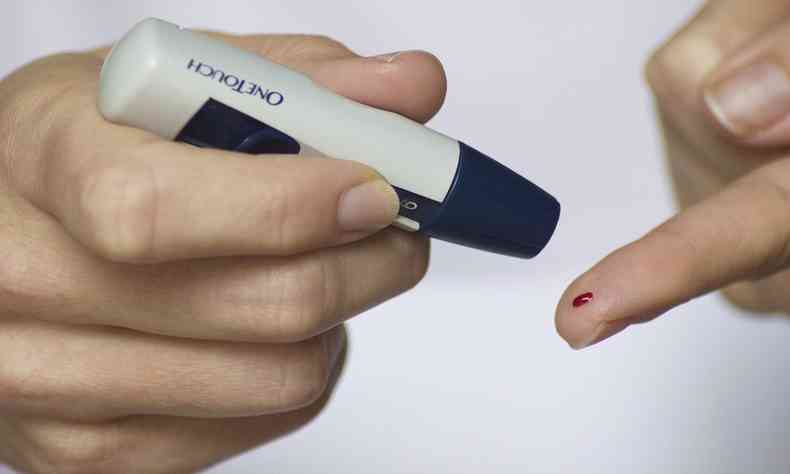
Um estudo feito pela Mayo Clinic e publicado pela Nature Communications aponta um novo tratamento para diabetes, por meio da geração de um produto celular capaz de proteger o organismo contra a hipoglicemia e também restaurar a regulação normal da glicose no sangue. O método já é comprovado em animais e está sendo preparado para a testagem em humanos.
“Este produto celular é um tecido humano derivado de células-tronco, que contém células alfa produtoras de glucagon, um elemento chave na prevenção da hipoglicemia em pacientes com diabetes. Quando essas células, derivadas de células-tronco, são transplantadas para modelos animais, elas são capazes de protegê-los da hipoglicemia. Essas células têm também potencial agregado quando combinadas com células beta derivadas de células-tronco”, explica o pesquisador da Mayo Clinic e autor do estudo, Quinn Peterson.
Este potencial agregado, citado por Peterson, pode ser percebido também na capacidade terapêutica desse método na substituição de células de glicose. Deste modo, essas células agiriam como uma espécie de remédio vivo para tratar a hiperglicemia, ou seja, o alto nível de açúcar no sangue, e proteger o organismo do diabético de uma queda da quantidade de açúcar na corrente sanguínea, chamada de hipoglicemia.
“Do ponto de vista terapêutico, as células-tronco produzidas são transplantadas para um receptor, e, a fim de proteger essas células do sistema imunológico, elas são encapsuladas em um dispositivo de bioengenharia que lhes permite sobreviver enquanto evita o ataque imunológico. Uma vez transplantadas, as células são capazes de detectar a glicose em seu ambiente e secretar insulina ou glucagon em resposta a essas condições”, diz Peterson sobre o funcionamento desse método no organismo do paciente.
A partir disso, de acordo com o pesquisador, os hormônios secretados, ou seja, a insulina e o glucagon, são liberados na corrente sanguínea para desempenhar a função de regular os níveis de glicose.
Esse mecanismo substitui, então, a administração de insulina, feita, normalmente, por uma bomba de insulina, e o monitoramento contínuo dos níveis de açúcar no sangue.
Esse mecanismo substitui, então, a administração de insulina, feita, normalmente, por uma bomba de insulina, e o monitoramento contínuo dos níveis de açúcar no sangue.
"Com pouca água, não se pode cozinhar o jantar. Porém, com muita água, a caixa transborda e danifica a casa. O pâncreas, e especificamente as ilhotas no pâncreas, desempenham o mesmo papel para a glicose no corpo, mantendo a glicose no sangue em uma faixa muito estreita. As células beta, que produzem insulina, são como a válvula de corte que diz que a caixa está cheia"
Quinn Peterson, pesquisador da Mayo Clinic e autor do estudo
“Dessa forma, trocamos duas tecnologias por um medicamento vivo que detecta os níveis de glicose e administra níveis terapêuticos apropriados de insulina e glucagon. Justamente por isso, nosso trabalho atual está focado na validação da tecnologia de encapsulamento que protegerá essas células do ataque imunológico durante o transplante, bem como na validação de processos de fabricação e regulatórios em antecipação a futuros ensaios clínicos”, afirma.
Analogicamente, Peterson explica que o papel do pâncreas e, especificamente, o papel das células alfa nesse processo pode ser pensado a partir de uma caixa d'água. Mas, como? De acordo com o especialista, essa associação pode ser feita considerando justamente a função da caixa d’água: garantir o abastecimento de água adequado para a casa.
“Com pouca água, não se pode cozinhar o jantar. Porém, com muita água, a caixa transborda e danifica a casa. O pâncreas, e especificamente as ilhotas no pâncreas, desempenham o mesmo papel para a glicose no corpo, mantendo a glicose no sangue em uma faixa muito estreita. As células beta, que produzem insulina, são como a válvula de corte que diz que a caixa está cheia”, diz.
Nesta linha de pensamento, Peterson elucida, ainda, que quando essas células beta secretam insulina, elas evitam que os níveis de glicose no sangue fiquem perigosamente altos.
Já as células alfa, que produzem glucagon, atuam como uma espécie de sensor, capaz de informar o organismo quando essa "caixa” ficar vazia, evitando, assim, que os níveis de glicose no sangue fiquem baixos. “O glucagon é um sinal para o corpo solicitar reserva de glicose armazenada em uma segunda caixa: o fígado.
Já as células alfa, que produzem glucagon, atuam como uma espécie de sensor, capaz de informar o organismo quando essa "caixa” ficar vazia, evitando, assim, que os níveis de glicose no sangue fiquem baixos. “O glucagon é um sinal para o corpo solicitar reserva de glicose armazenada em uma segunda caixa: o fígado.
Processo de validação
“Do ponto de vista do tratamento, quando disponível, esta terapia revolucionará a forma como tratamos a diabetes. Em vez de administrar uma dose pré-determinada de medicamento ou insulina várias vezes ao dia, uma terapia de substituição celular é capaz de se adaptar às condições minuto a minuto e administrar doses apropriadas de hormônios para controlar com mais precisão os níveis de glicose no sangue. O medicamento vivo atende às necessidades do paciente ao mesmo tempo em que reduz a carga de gerenciamento da doença”, afirma o pesquisador.
Por isso, Peterson diz que os trabalhos e pesquisas continuam, a fim de melhorar a abordagem na preparação de testes em humanos, previstos para 2022. “Até o momento, realizamos a avaliação desta terapia em modelos animais pré-clínicos. É importante ressaltar que agora temos a capacidade de fabricar grandes quantidades de tipos de células extremamente importantes que são necessárias para prevenir a hipoglicemia e regular a glicose no sangue em pacientes com diabetes”, comenta.
Pensando no futuro, o pesquisador explica que essas células, se introduzidas com sucesso no uso clínico, podem, sozinhas ou em combinação com células beta derivadas de células-tronco, mudar drasticamente o tratamento de pacientes diabéticos.
“Em vez de depender de exames de sangue de rotina para prevenir a hipoglicemia e intervenções de emergência para tratar a hipoglicemia grave, no futuro, os pacientes poderão receber um transplante de medicamento vivo que monitorará os níveis de glicose no sangue e administrará doses corretivas de glucagon.”
“Em vez de depender de exames de sangue de rotina para prevenir a hipoglicemia e intervenções de emergência para tratar a hipoglicemia grave, no futuro, os pacientes poderão receber um transplante de medicamento vivo que monitorará os níveis de glicose no sangue e administrará doses corretivas de glucagon.”

“Em alguns momentos, os níveis de glicose caíam perigosamente e, então, tentava fazê-los beber um pouco de suco para elevar a quantidade de açúcar no sangue. Saber as lutas que os pacientes enfrentam com a hipoglicemia, mesmo com a melhor tecnologia, me motivou a olhar além das células beta e investigar a capacidade de produzir células alfa, que podem prevenir essa hipoglicemia. Minha esperança é que, um dia, esse trabalho proporcione não apenas alívio médico, mas também paz de espírito aos pacientes e famílias que sofrem com essa doença”, diz.
* Estagiária sob a supervisão da editora Teresa Caram
