Desde o século V antes de Cristo e mesmo sem nenhum recurso tecnológico, o filósofo grego Demócrito de Abdera já acreditava que toda a matéria seria formada por átomos. Ele concluiu que, para explicar a existência do mundo tal como o conhecemos, a divisão da matéria não pode ser infinita, isto é, que há um limite indivisível, o átomo. Para ele, os átomos se comportavam da mesma forma que as partículas de poeira contrastando com um raio de sol: aleatoriamente, alguns se aglomerando, outros se dispersando, outros ainda nunca se juntando com outro átomo.
Esse conceito antigo do átomo foi consolidado na ciência em 1808, pelo cientista inglês John Dalton, que comprovou erroneamente por experimentos científicos limitados que o átomo seria indivisível, maciço e com forma esférica. Na sua opinião a matéria seria formada por bolas de bilhares empilhadas, que poderiam ser arranjadas, gerando novas substâncias.

Somente em 1911, o químico e físico neozelandês, Ernest Rutherford, contestou a Teoria de Dalton através de uma experiência relativamente simples. Para verificar se os átomos eram maciços, Rutherford bombardeou uma fina lâmina de ouro com pequenas partículas de carga positivas, denominada partículas alfa, emitidas por um material radioativo proveniente do polônio.
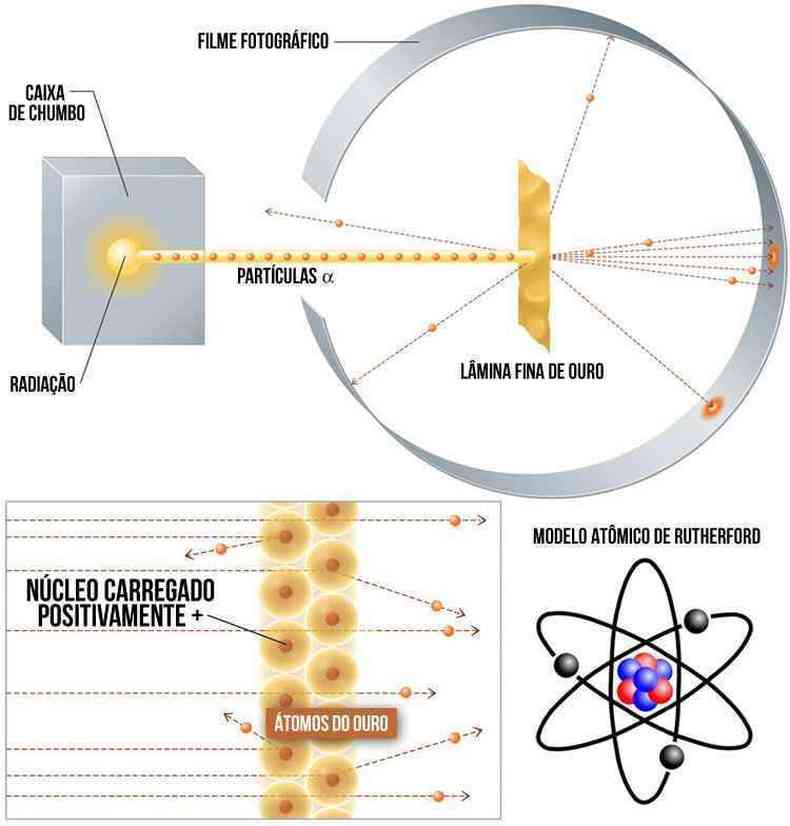
Ele observou que a maior parte dessas partículas atravessava a lâmina, algumas eram repelidas e outras eram desviadas. A conclusão que ele chegou era átomo possui um grande vazio e seria formada por outras partículas: os prótons e elétrons. O átomo seria constituídos por um núcleo carregado positivamente e uma nuvem eletrônica carregada negativamente. Essa nuvem eletrônica era composta por elétrons que giravam em órbitas elípticas ao redor do núcleo, como o sistema solar. Esse era o motivo pelo qual, algumas partículas foram repelidas, pois elas bateram no núcleo atômico de ouro. Enquanto as que foram desviadas, elas passaram muito perto do núcleo do ouro que era positivo, gerando uma repulsão.
Seu modelo atômico - mesmo que errado - é uma grande avanço nos estudos sobre o átomo e deu um passo enorme na forma como era compreendida a matéria desde então. Devido a isso, Rutherford é considerado o pai da física nuclear.
Quer saber mais? Assista a aula do prof. Marquinhos sobre o assunto.
Artigo do Percurso Pré-vestibular e Enem.
