O "pH" ou o "potencial hidrogeniônico" presente em uma determinada substância é utilizado para medir os níveis de acidez e basicidade (alcalinidade). Esse potencial refere-se à quantidade (concentração molar) de cátions hidrônio (H+ ou H3O ) presentes no meio. Ela vai definir através de uma escala numérica adimensional se a substância é ácida, neutro e básica.

As medidas de pH são tão importantes que vão além do seu uso na química, como na agricultura, na agronomia, na aquicultura, na biologia, nas engenharias, na medicina, no tratamento e purificação de água.
O pH e a qualidade da cerveja
O termo "pH" foi introduzido em 1909, pelo bioquímico dinamarquês Søren Peter Lauritz Sørensen com o objetivo de facilitar seus trabalhos no controle de qualidade de cervejas na Carlsberg. Na cervejaria, Søren começa a realizar diversas experiências químicas relacionadas com aminoácidos, proteínas e enzimas, onde descobriu a medição do pH - marcando seu nome nas grandes realizações da química na história da humanidade.
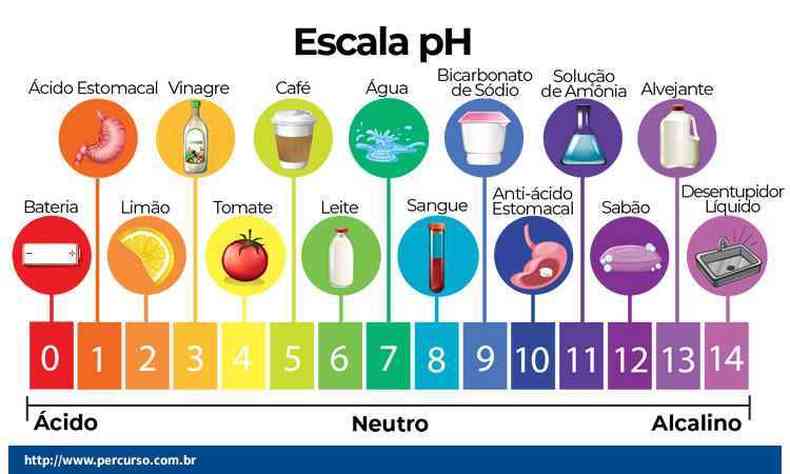
Escala pH
Os valores de pH são calculados matematicamente considerando as concentrações de H-e (OH) presentes em uma solução. O pH é representado numa escala que varia de 0 a 14. Sendo o pH 7 representa uma solução neutra (água pura). Já os que estão antes dele são consideradas soluções ácidas (pH ácido), e os que estão após o 7 são as soluções básicas (pH alcalino).
O caráter ácido é crescente da direita para a esquerda. Já o caráter básico, da esquerda para a direita. Lembrando que, quanto menor o valor do pH, mais ácida será a solução ou mistura. É possível misturar ácidos com bases até conseguir um pH neutro. Esse processo chama-se neutralização e consistem em um tipo de reação química.
Calculando o pH
Para calcular o pH de uma solução ou mistura, podemos utilizar equações de logaritmos na base 10:
- pH = - log [H3O ]
- pH = - log [H ]
- [H3O ] = 10-pH (ideal para ser utilizada caso o ph seja um número inteiro)
Os cálculos envolvendo o pH de uma solução estão sempre relacionados com o pOH (potencial hidroxiliônico/OH-), já que baseiam-se na auto-ionização da água (Kw = 10-14, fenômeno no qual a água produz tanto H quanto OH-) e na lei da diluição de Ostwald (quanto mais diluída uma solução, maior a quantidade de cátions H ).
Em relação à auto-ionização da água:
Kw = [H ] . [OH-], por isso pH pOH = 14
Kw = Constante da auto-ionização da água
Em relação a lei de diluição de Ostwald - por meio dela, podemos saber quanto um determinado material ioniza-se ou se dissocia na água):
Ki = M.α2
Ki = Constante de ionização de uma substância em meio aquoso;
M = molaridade ou concentração molar da substância no meio aquoso;
α2 = grau de ionização ou dissociação do material no meio.
A classificação de uma solução em ácida, básica ou neutra terá os seguintes critérios (25°C):
- Uma solução será neutra quando a concentração de H for igual à concentração de OH- ou ter pH igual a 7.
- Uma solução será ácida quando a concentração de H for maior que a concentração de OH- ou o pH estiver entre 0 e 7. [H ] > [OH-]
- Uma solução será básica quando a concentração de H for menor que a concentração de OH- ou o pH estiver entre 7 e 14. [H ] < [OH-]
Artigo de Química do Percurso Pré-Vestibular e Enem.
