Pesquisadores da Universidade Federal de São Carlos (UFSCar) em Sorocaba transformaram, pela primeira vez, uma enzima não luminescente em uma enzima capaz de gerar luz, por meio de engenharia genética. O processo só foi possível após a descoberta de uma outra enzima – considerada o “elo perdido” na evolução dos animais que emitem luz, como vaga-lumes, águas-vivas e alguns besouros.
Os resultados foram publicados no periódico Biochemistry, da Associação Americana de Química (ACS, na sigla em inglês), nos Estados Unidos. A pesquisa tem apoio da FAPESP.
Sabe-se que a geração de luz em organismos vivos, chamada bioluminescência, só é possível graças a um grupo de enzimas chamadas luciferases. Há décadas, porém, os cientistas tentavam descobrir como se deu a evolução dessas enzimas, de que forma uma enzima que não produzia luz passou a ser luminescente.
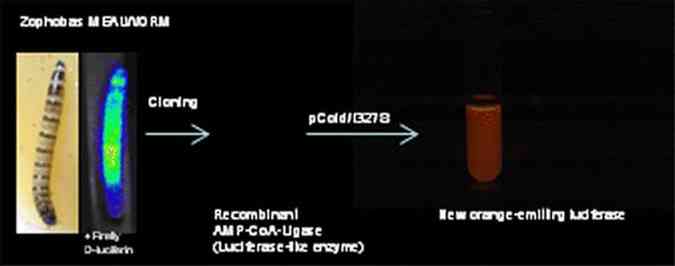
O grupo do professor Vadim Viviani, do Laboratório de Bioquímica e Biotecnologia de Sistemas Bioluminescentes da UFSCar, encontrou essa resposta em uma enzima considerada como "prima distante" das luciferases. Ela fica no sistema excretor da larva do besouro não luminescente Zophobas morio, muito usada como isca de pesca, conhecida popularmente como bicho-da-farinha ou tenébrio.
Apesar de sua falta de brilho, a enzima no sistema excretor da larva emite uma luz fraquíssima se adicionada a ela o composto luciferina de vaga-lume (que a larva do besouro não tem).
"A quantidade de luz é tão baixa que ela não é considerada luminescente; entretanto, a estrutura molecular da enzima é parecida com aquela das enzimas luciferases, colocando-as dentro da mesma família de enzimas", disse Viviani.
Essa parente distante das luciferases – considerada agora o “elo” entre as enzimas não luminescentes do passado e as luciferases modernas – faz parte de um grupo maior de enzimas, chamadas AMP/CoA-ligases, classe antiga encontrada em todos os organismos e envolvida com o metabolismo de ácidos orgânicos.
"São enzimas essenciais para todos os organismos, das bactérias aos seres humanos", disse Viviani. Só que suas funções variam, dependendo do tecido, órgão ou organismo em que são encontradas.
"Em plantas, por exemplo, algumas dessas enzimas são responsáveis pelo processo de pigmentação. Em bactérias, fazem parte do metabolismo de compostos tóxicos. Em animais, a maioria delas participa do metabolismo de gorduras. Já nos vaga-lumes, produzem luz", disse o pesquisador
Viviani e Rogilene Prado, bolsista de pós-doutorado da FAPESP e pesquisadora no Centro de Ciências e Tecnologias para a Sustentabilidade, descobriram um “interruptor” estrutural que transforma as enzimas AMP-ligases, até então escuras, em luciferases, produtoras de luz.
Com isso, conseguiu-se produzir uma luciferase de luz laranja totalmente nova a partir de uma AMP-ligase. "Descobrimos qual aminoácido devemos trocar para fazer com que a enzima passe a emitir luz suficiente para ser considerada luminescente", disse Viviani.
Apesar de a cor não ser novidade — existem luciferases que naturalmente emitem luz parecida —, o feito é inédito. "É a primeira vez na literatura científica que esse processo é descrito", afirmou Viviani.
Possíveis aplicações
A pesquisa abre caminho para o desenvolvimento de AMP-ligases bioluminescentes, de biossensores luminosos para ácidos tóxicos orgânicos, por exemplo, para saber se um inseto é resistente a um determinado inseticida de natureza ácida (lembrando que as AMP-ligases, inclusive as luciferases, atuam sobre compostos ácidos, em alguns casos detoxificando-os), e de luciferases que brilham em várias cores mais intensas do que as atuais.
As luciferases já são amplamente utilizadas como poderosos biomarcadores, capazes de auxiliar na detecção de células patogênicas, processos de infecção e até na descoberta de novas drogas.
"A utilização de biomarcadores luminosos em processos metabólicos aumenta a compreensão de como os organismos funcionam, quais caminhos as substâncias tomam e se uma determinada técnica funciona", explicou Viviani. É como se, de repente, ao observar uma cidade de cima, fosse possível iluminar apenas as mulheres ou os homens; ou quem anda de carro, moto ou ônibus; ou quem veste roupa azul ou amarela.
O trabalho publicado pela Biochemistry também contou com a participação do estudante de Biologia Deimison Neves, da UFSCar de Sorocaba, do professor Daichiro Kato, da Universidade de Hyogo, do Japão, e do professor João A. Barbosa, da Universidade Federal de Brasília (UnB).
O grupo de pesquisadores fez o depósito de um pedido de patente no Instituto Nacional da Propriedade Industrial (INPI), descrevendo o desenvolvimento de uma nova luciferase a partir de AMP-ligase, e a utilização da enzima como biossensor para compostos ácidos.
