Paxlovid, antiviral oral para COVID, tem registro definitivo da Anvisa
Antiviral oral da Pfizer, o medicamento (nirmatrelvir e ritonavir) atua no tratamento da infecção leve a moderada em pacientes com risco aumentado de progressão para casos graves da doença. Disponível no SUS e no sistema privado
compartilhe
Siga no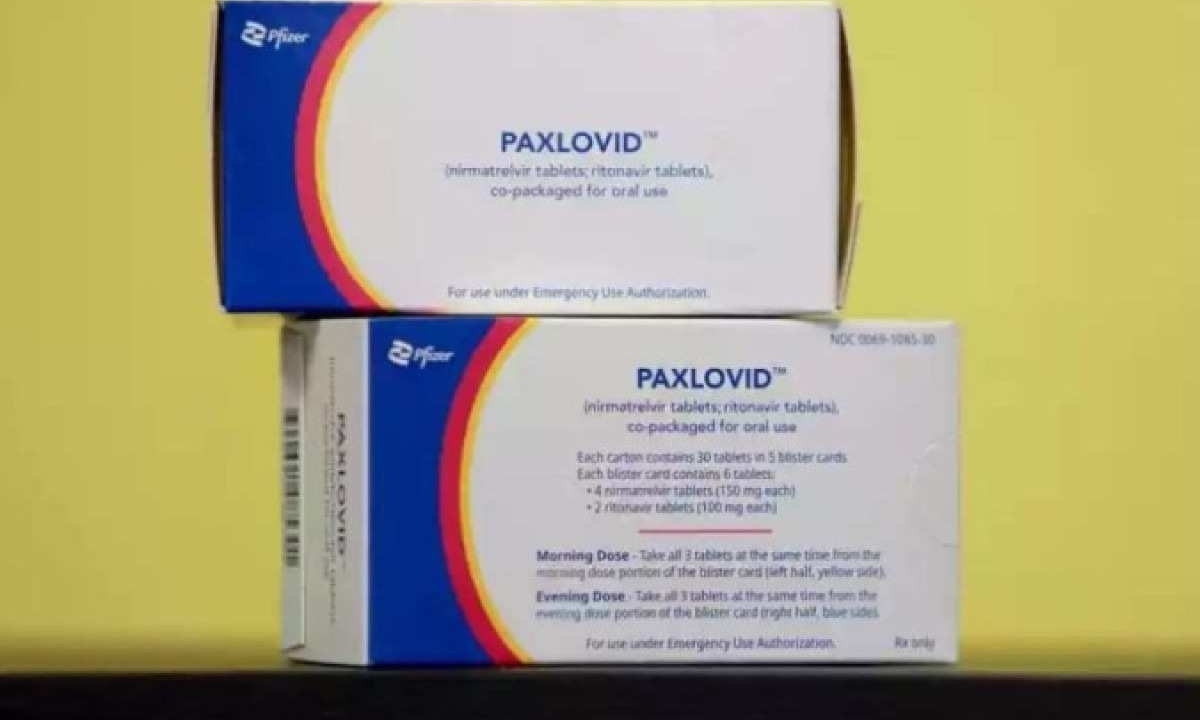
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro definitivo do medicamento Paxlovid (nirmatrelvir e ritonavir) para o tratamento da COVID-19 nas formas leve e moderada, em pacientes com risco aumentado de evolução para formas graves da doença.

15/12/2023 - 09:06 Casos de covid-19 aumentam em estados do Nordeste 
22/12/2023 - 09:57 Menos de 20% dos brasileiros tomaram a vacina bivalente contra a Covid 
01/01/2024 - 10:27 Vacina contra a Covid entra para o calendário infantil do Ministério da Saúde
“Uma a cada cinco pessoas no mundo tem pelo menos um fator de risco que poderia piorar os sintomas da COVID-19. Esse é mais um avanço importante no tratamento da doença, especialmente para pacientes com problemas cardíacos, renais, diabetes, idosos, tabagistas, com obesidade ou que tratam câncer, ou outras condições que afetam a imunidade. Ao receber o registro definitivo desse medicamento, reafirmamos mais uma vez sua qualidade, segurança e eficácia”, afirma Adriana Ribeiro, diretora médica da Pfizer Brasil.
Leia: COVID longa está ligada a dano duradouro na mitocôndria; entenda
Paxlovid atua na inibição de uma enzima do SARS-CoV-2, a protease 3CL, e foi desenvolvido para ser administrado por via oral, com uma dose de 300 mg (dois comprimidos de 150 mg) de nirmatrelvir e um comprimido de 100 mg de ritonavir, que devem ser tomados duas vezes por dia. O tratamento deve ser iniciado em até cinco dias do início dos sintomas, contribuindo assim para evitar o agravamento da doença.
O medicamento é indicado para o tratamento da COVID-19 em adultos que não requerem oxigênio suplementar, ou seja, que apresentem as formas leve e moderada da doença e que tenham ao menos um fator de risco de progressão para o quadro grave da doença. O antiviral demonstrou em estudos clínicos que, em comparação ao placebo, reduz em até 89% a possibilidade de hospitalização ou morte em pacientes do grupo elegível.
Medicamento está disponível no SUS e no mercado privado
No sistema público, o tratamento é oferecido para grupos específicos de pacientes, sendo eles: pessoas a partir de 18 anos que apresentem imunossupressão de acordo com os critérios do Programa Nacional de Imunização (PNI) ou idosos a partir de 65 anos.
Para ter acesso ao medicamento pelo Sistema Único de Saúde (SUS), além de se enquadrar no perfil do público-alvo especificado pelo governo, o paciente deve ter um exame positivo para a COVID-19 (o que não inclui o autoteste), laudado e realizado por um profissional de saúde, a prescrição médica e formulário de prescrição presente no guia desenvolvido pelo Ministério da Saúde. Com a documentação de liberação em mãos, o paciente pode ir a um local de dispensação indicado e retirar o tratamento.
Leia: Variantes da COVID têm mutações geradas por antiviral; diz pesquisa
O antiviral também está disponível no mercado privado, nas principais redes de farmácias do país, sob prescrição médica.
