Carolina Cotta
A identificação de duas proteínas produzida pelo parasita Leishmania amazonensis pode explicar por que ele consegue conviver harmoniosamente com células que deveriam matá-lo. O sequenciamento do genoma do Leishmania amazonensis, um dos causadores da leishmaniose cutânea e difusa, demorou quatro anos para ser concluído, mas viabilizou a identificação de proteínas que poderiam subverter as defesas do organismo hospedeiro, participando da evasão do seu sistema imunológico. O sequenciamento em si foi realizado de maneira automatizada em um equipamento de última geração nos Estados Unidos, mas todo o processamento e a análise dos genes envolvidos são mérito de pesquisadores brasileiros.
Coordenado pela doutora em bioquímica e biologia molecular Diana Bahia, do Departamento de Biologia Geral da Universidade Federal de Minas Gerais (UFMG), o estudo é uma colaboração com o Departamento de Microbiologia, Imunologia e Parasitologia (DMIP) da Escola Paulista de Medicina da Universidade Federal de São Paulo (Unifesp), além de grupos do Laboratório Nacional de Biociências (LNBio), de Campinas, e do Laboratório de Genômica e Expressão da Universidade Estadual de Campinas (Unicamp). No artigo “The genome sequence of Leishmania(L.) amazonensis: functional annotation and extended analysis of gene models”, publicado na revista científica DNA Research, eles mostram como duas proteínas sintetizadas e secretadas pelo protozoário imitam a do hospedeiro.
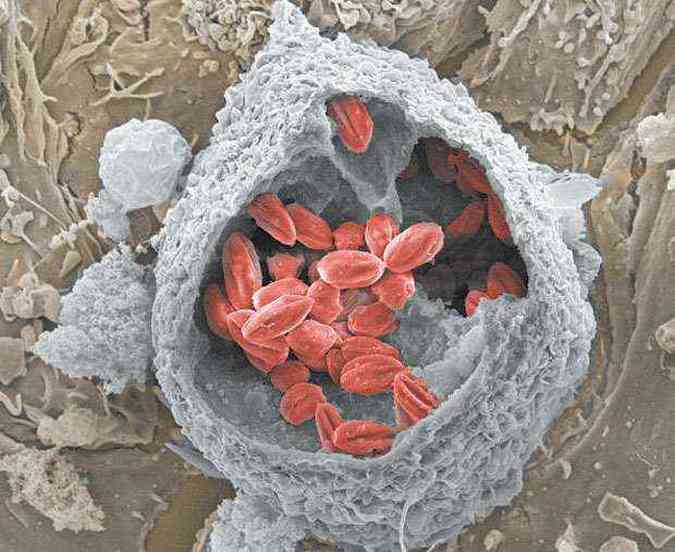
Segundo Diana Bahia, essa imitação permite a ligação dessas proteínas a componentes do arsenal imunológico do indivíduo infectado, bloqueando sua ativação e silenciando a resposta inflamatória. O estudo também avançou na investigação dos genes relacionados à formação de um vacúolo (chamado vacúolo parasitóforo), bolsa que abriga o parasita no interior dos macrófagos, células de defesa que os englobam e tentam destruí-los (foto). Nela, o parasita se multiplica e resiste a eventuais ataques do sistema imunológico.
Segundo o doutor em Microbiologia e Imunologia Fernando Real, do DMIP, um dos pesquisadores e autores principais, no caso de Leishmania amazonensis e da sua espécie-irmã Leishmania mexicana, essa bolsa é bem mais espaçosa do que as formadas por outras espécies de protozoários causadores da leishmaniose. “Essa pode ser uma das maneiras de o parasita subverter e enganar o sistema imunológico do hospedeiro”, acredita. A motivação para o estudo, inclusive, veio do fato de a Leishmania amazonensis residir nesse vacúolo mais espaçoso dentro dos macrófagos, ao contrário da Leishmania major e da Leishmania braziliensis, que residem em vacúolos mais apertados, justapostos ao corpo do parasita.
“O vacúolo criado pelo parasita, quando está em sua forma amastigota, ou seja, intracelular, parece ser um mecanismo elaborado, usado para sua multiplicação e proteção contra o ataque do sistema imune do hospedeiro. Esse vacúolo largo é uma característica ainda pouco estudada, até o momento descrita apenas para as espécies do complexo mexicana”, explica Diana. Daí a importância do genoma, que proveu os pesquisadores de informações sobre proteínas expostas ou secretadas pelo parasita, principalmente na forma amastigota, que auxiliassem na formação desse vacúolo. Dessa maneira, seria possível entender o possível mecanismo biológico por trás de sua sobrevivência dentro do macrófago e, consequentemente, encontrar meios de neutralizar seu ciclo intracelular.
O genoma de um organismo funciona como um manual de instruções do seu funcionamento. Ele provê indicações de que genes estariam relacionados com problemas científicos e médicos na investigação desses parasitas. É preciso tomar toda a informação decorrente do sequenciamento e, pontualmente, investigar a participação efetiva dos genes preditos (aqueles anotados como tendo características de genes) na manifestação clínica da doença, por exemplo, ou na formação do vacúolo parasitóforo, para aqueles mais interessados na pesquisa básica. “O genoma ‘abre mais portas do que fecha’. Temos mais perguntas a investigar do que respostas”, acrescenta Diana.
No estudo, os pesquisadores buscaram identificar genes espécie-específicos em Leishmania amazonensis e Leishmania mexicana que poderiam estar relacionados à leishmaniose cutânea difusa. Segundo Diana, são pouquíssimos os genes encontrados apenas nessas duas espécies. Independentemente da manifestação da doença, as espécies de Leishmania são muitíssimo parecidas: mais de 90% dos genes fazem parte de um repertório comum ao gênero. Mas o que aparentemente faz a diferença é a quantidade de cópias de cada gene. “Encontramos muitos genes expandidos (aqueles que se apresentam em maior numero de cópias em dado organismo) em número de cópias nas duas espécies. Talvez esses genes estejam envolvidos nas peculiares manifestações clínicas provocadas por esses parasitas e na homeostase (condição de relativa estabilidade que o organismo necessita para realizar suas funções adequadamente) entre parasita e hospedeiro”, explica
Vida em silêncio
Esses parasitas estão adaptados para viver silenciosamente no hospedeiro, até que alguma deficiência do sistema imune permita que ele saia de sua forma latente e desenvolva as lesões no mesmo. Umas espécies, contudo, parecem mais adaptadas do que outras – mais agressivas – a viver silenciosamente em determinados hospedeiros, fenômeno ainda pouco estudado. Segundo dados da Organização Mundial de Saúde (OMS), boa parte dos mamíferos reservatórios e de humanos infectados pela Leishmania amazonensis não apresentam lesões. “Por isso acreditamos que esse protozoário seja uma dessas espécies que evoluíram de modo a adquirir vantagens em uma vida intracelular e a se adaptar a viver silenciosamente no hospedeiro”, explica a pesquisadora da UFMG.
Do ponto de vista médico, o sequenciamento genômico possibilita a identificação de genes importantes para o estabelecimento do parasita e para sua disseminação pelo organismo. Alguns produtos desses genes preditos podem ser potenciais alvos de vacinação (profilática ou terapêutica) ou para desenho de drogas que impeçam a continuidade da doença. Do ponto de vista biológico, o genoma pode revelar fatores para a biogênese do vacúolo largo, no qual esses parasitas vivem, permitindo a investigação do estado de latência que esses parasitas podem atingir em infecções crônicas, e também para a investigação do tropismo (movimentação) do parasita do sítio da picada do inseto até outras regiões na doença disseminada.
A pesquisa foi realizada com financiamento do projeto Jovem Pesquisador da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) e por meio de bolsas do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Melhor entendimento da comunicação celular
Com o genoma do parasita Leishmania amazonensis sequenciado, surgem mais possibilidades para a investigação da biologia dessa espécie, que pode ser feita, inclusive, em comparação com os genomas de outras espécies de Leishmania. A apresentação do genoma deve ser o início, e não o fim, de uma série de experimentações a fim de se checar a relevância médica e biológica dos genes preditos. Um dos próximos passos, segundo Diana Bahia, é, a partir do isolamento dos largos vacúolos parasitóforos formados por essa espécie, mapear que componentes do hospedeiro e que estruturas do parasita fazem parte dessa estrutura. Além disso, torna-se viável a identificação de proteínas do parasita que participam da sinalização celular, ou seja, fosforilam e ativam substratos, em uma cascata de eventos de comunicação celular. Essas proteínas têm sido amplamente estudadas como alvo de drogas para doenças proliferativas, como o câncer. Para os pesquisadores, a interferência em algumas dessas vias de sinalização, por meio de desenho de drogas específicas, poderá ser um futuro promissor para o controle da manifestação da doença causada pelo parasita.
Causador de graves lesões
Leishmania é um gênero de protozoários que inclui os parasitas causadores das leishmanioses. As espécies são transmitidas por mosquitos do gênero Phlebotomus, no Velho Mundo, e do gênero Lutzomyia, no Novo Mundo, e seus hospedeiros primários são mamíferos como cães e camundongos, além de répteis. Leishmania amazonensis faz parte do chamado “complexo mexicana”, também composto pela espécie Leishmania mexicana. A Leishmania mexicana foi classificada, em 1953, por Francisco Biagi, como agente causador da úlcera dos chicleros, lesão cutânea comum entre trabalhadores rurais da América Central. A Leishmania amazonensis foi descoberta pelos professores Jeffrey Shaw (da Universidade Federal de São Paulo) e Ralph Lainson (do Instituto Evandro Chagas), em 1972.
Das mais de 20 espécies descritas, as do complexo mexicana provocam lesões crônicas, nodulares e muitas vezes disseminadas em humanos. Já Leishmania amazonensis encontra-se predominante no Brasil, na Bacia Amazônica, e está envolvida em manifestações cutâneas que abrangem formas simples (nódulo ou lesão simples), difusas (vários nódulos na região infectada) e disseminadas (vários nódulos espalhados por outras regiões do corpo). Essa tem maior envolvimento em uma forma mais grave e de difícil tratamento dessas manifestações cutâneas disseminadas. A forma anérgica difusa leva a sérias lesões desfigurantes no indivíduo que se assemelham à lepra e é praticamente impossível de serem curadas.
