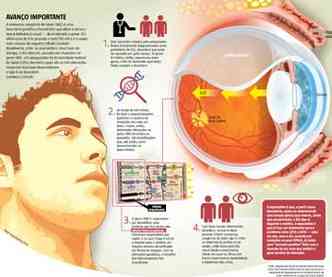
Cegos e em busca de esperança, dois jovens do estado de Goiás foram ao consultório do oftalmologista Luís Alexandre Rassi Gabriel. De famílias distintas, ambos apresentavam os mesmos sintomas clínicos: desde que nasceram, não enxergavam quase nada; coçavam os olhos com força; os órgãos apresentavam movimentos involuntários e repetitivos, além de serem muito fundos; e as células da retina não apresentavam atividade elétrica, o que impedia que o que foi observado chegasse ao cérebro em forma de imagem. Todos esses fatores levaram ao prognóstico de que a dupla sofria de amaurose congênita de Leber (ACL), desordem genética que é a principal causa da cegueira infantil hereditária. Não satisfeito com os resultados, Gabriel, chefe do Departamento de Genética Ocular do Centro de Referência em Oftalmologia da Universidade Federal de Goiás (UFG), decidiu investigar o que provocava o problema nos jovens e descobriu que três mutações no gene CRB1 eram as culpadas pela ABL tipo 8, modificações que, até então, eram desconhecidas na área médica.
Foram seis meses de pesquisa até que o oftalmologista chegasse à descoberta. “A desordem, que atinge três indivíduos em cada 100 mil, pode ser causada por, no mínimo, 16 genes. Fiz o sequenciamento e a análise de alterações em cada um deles, até que foi possível detectar as mutações no CRB1 de ambos os pacientes”, descreve o pesquisador. De acordo com a análise, que será apresentada em maio na 14ª Conferência de Pesquisa da Visão, nos Estados Unidos, e publicada na revista científica Vision Research, essas mutações podem ser herdadas dos pais ou adquiridas ao acaso. “Como essa desordem exige a presença de duas alterações para se manifestar é possível que o paciente tenha uma delas devido a um dos progenitores e outra que surgiu aleatoriamente.”
Para que uma pessoa enxergue, as células fotorreceptoras captam a luz e, por meio de uma proteína que fica dentro dessas estruturas, enviam para o cérebro impulsos nervosos que são convertidos em imagens. “Nos pacientes com ACL, falta essa proteína ou ela não funciona corretamente”, observa o oftalmologista Hilton Medeiros, da Clínica de Olhos João Eugênio, de Brasília. Ele explica que quem tem a distrofia basicamente nasceu “programado para ter aquele problema de saúde” e destaca que, embora a maioria dos pacientes não tenha outras doenças associadas, há pessoas com amaurose que apresentam alterações no sistema nervoso central. No caso da amaurose congênita de Leber tipo 8, o problema faz com que a proteína do gene CRB1 não trabalhe de maneira adequada dentro dos fotorreceptores, prejudicando a visão.
Apesar de, normalmente, os primeiros sinais desse problema de saúde aparecerem no início da infância, o oftalmologista retinólogo Sebastião Ferreira Neto, da Oftalmed, ressalta que há casos de crianças com ACL que já nascem cegas e outros indivíduos cujo distúrbio só vai se manifestar na vida adulta. Atualmente, só há tratamento para a amaurose causada pela mutação no gene RPE65 (veja Saiba mais). “A terapia de mudança genética consiste em inserir em um vírus o gene intacto e implantar esse agente invasor na parte de trás da retina”, detalha. “Desse modo, é possível corrigir o gene que tem a mutação e recuperar, mesmo que não seja 100%, a capacidade de o paciente enxergar”, afirma Neto.
Precisão
A grande importância dessa pesquisa é identificar o local exato do causador da desordem genética, já que estudos anteriores comprovaram que a terapia gênica é o meio para tratar distrofias como essa. “À medida que sabemos quais são os genes envolvidos na ACL, fica mais fácil determinar como se deve cuidar de cada caso”, garante o médico da Oftalmed. Medeiros concorda: “Se você está cuidando de uma doença com alvo em um lugar, mas ela acontece em outro, não adianta”. É o mesmo que tomar remédios para dor de cabeça, sendo que a fonte do problema é ter pressão alta: os resultados serão ineficazes.
O pesquisador de Goiás acredita que seus dois pacientes e todas as pessoas que sofrem com o tipo 8 da distrofia terão acesso a tratamentos — que vêm sendo desenvolvidos por laboratórios holandeses — entre 2013 e 2014. “Essa descoberta mostrou que podemos ir mais adiante com os casos de ACL, esclarecendo para nossos pacientes a causa exata de suas doenças e aproximando-os de uma terapia com caráter até mesmo curativo”, ressalta.
Se, como estimado, o tratamento com genes estiver disponível nos próximos dois anos, o oftalmologista da Clínica de Olhos João Eugênio afirma que a iniciativa vai abrir ainda mais o campo de ação para devolver a qualidade de vida para pessoas com distúrbios considerados incapacitantes. “Vamos devolver esses jovens, em idade produtiva, para o mercado de trabalho e para uma vida social melhor”, comemora. Enquanto o tratamento adequado não chega aos consultórios médicos, medidas paliativas ajudam a lidar com o problema. “Um deles é fazer a estimulação visual”, comenta Neto. Gabriel, por sua vez, diz que recomenda a seus pacientes que evitem o excesso de luminosidade, já que a luz faz com que a retina produza metabólitos que não conseguem ser absorvidos por causa da doença. “Assim, eles se acumulam e degeneram a retina. Então, quanto menos luz, menor a quantidade de metabólitos e, portanto, menores são os danos.” Para isso, as pessoas devem usar boné, chapéu e óculos escuros sempre que for possível.
Correção da células
A amaurose congênita de Leber causada por uma mutação no gene RPE65 é o único tipo da distrofia que tem tratamento. Como o Estado de Minas mostrou em 23 de fevereiro, a equipe de médicos liderados pela oftalmologista Jean Bennett, da Universidade da Pensilvânia, corrigiu a alteração genética ao enviar para as células da retina o componente da visão que faltava nelas. Os pesquisadores pegaram o vírus AAAV8 e o modificaram, de modo que ele pudesse transportar o gene completo, sem mutações. Em seguida, o vírus é injetado na retina, por meio de uma cirurgia. Esse vetor, então, insere o gene no núcleo da célula, que vai fazer com que a estrutura produza as proteínas necessárias para o funcionamento adequado da visão.
Foram seis meses de pesquisa até que o oftalmologista chegasse à descoberta. “A desordem, que atinge três indivíduos em cada 100 mil, pode ser causada por, no mínimo, 16 genes. Fiz o sequenciamento e a análise de alterações em cada um deles, até que foi possível detectar as mutações no CRB1 de ambos os pacientes”, descreve o pesquisador. De acordo com a análise, que será apresentada em maio na 14ª Conferência de Pesquisa da Visão, nos Estados Unidos, e publicada na revista científica Vision Research, essas mutações podem ser herdadas dos pais ou adquiridas ao acaso. “Como essa desordem exige a presença de duas alterações para se manifestar é possível que o paciente tenha uma delas devido a um dos progenitores e outra que surgiu aleatoriamente.”
Para que uma pessoa enxergue, as células fotorreceptoras captam a luz e, por meio de uma proteína que fica dentro dessas estruturas, enviam para o cérebro impulsos nervosos que são convertidos em imagens. “Nos pacientes com ACL, falta essa proteína ou ela não funciona corretamente”, observa o oftalmologista Hilton Medeiros, da Clínica de Olhos João Eugênio, de Brasília. Ele explica que quem tem a distrofia basicamente nasceu “programado para ter aquele problema de saúde” e destaca que, embora a maioria dos pacientes não tenha outras doenças associadas, há pessoas com amaurose que apresentam alterações no sistema nervoso central. No caso da amaurose congênita de Leber tipo 8, o problema faz com que a proteína do gene CRB1 não trabalhe de maneira adequada dentro dos fotorreceptores, prejudicando a visão.
Apesar de, normalmente, os primeiros sinais desse problema de saúde aparecerem no início da infância, o oftalmologista retinólogo Sebastião Ferreira Neto, da Oftalmed, ressalta que há casos de crianças com ACL que já nascem cegas e outros indivíduos cujo distúrbio só vai se manifestar na vida adulta. Atualmente, só há tratamento para a amaurose causada pela mutação no gene RPE65 (veja Saiba mais). “A terapia de mudança genética consiste em inserir em um vírus o gene intacto e implantar esse agente invasor na parte de trás da retina”, detalha. “Desse modo, é possível corrigir o gene que tem a mutação e recuperar, mesmo que não seja 100%, a capacidade de o paciente enxergar”, afirma Neto.
Precisão
A grande importância dessa pesquisa é identificar o local exato do causador da desordem genética, já que estudos anteriores comprovaram que a terapia gênica é o meio para tratar distrofias como essa. “À medida que sabemos quais são os genes envolvidos na ACL, fica mais fácil determinar como se deve cuidar de cada caso”, garante o médico da Oftalmed. Medeiros concorda: “Se você está cuidando de uma doença com alvo em um lugar, mas ela acontece em outro, não adianta”. É o mesmo que tomar remédios para dor de cabeça, sendo que a fonte do problema é ter pressão alta: os resultados serão ineficazes.
O pesquisador de Goiás acredita que seus dois pacientes e todas as pessoas que sofrem com o tipo 8 da distrofia terão acesso a tratamentos — que vêm sendo desenvolvidos por laboratórios holandeses — entre 2013 e 2014. “Essa descoberta mostrou que podemos ir mais adiante com os casos de ACL, esclarecendo para nossos pacientes a causa exata de suas doenças e aproximando-os de uma terapia com caráter até mesmo curativo”, ressalta.
Se, como estimado, o tratamento com genes estiver disponível nos próximos dois anos, o oftalmologista da Clínica de Olhos João Eugênio afirma que a iniciativa vai abrir ainda mais o campo de ação para devolver a qualidade de vida para pessoas com distúrbios considerados incapacitantes. “Vamos devolver esses jovens, em idade produtiva, para o mercado de trabalho e para uma vida social melhor”, comemora. Enquanto o tratamento adequado não chega aos consultórios médicos, medidas paliativas ajudam a lidar com o problema. “Um deles é fazer a estimulação visual”, comenta Neto. Gabriel, por sua vez, diz que recomenda a seus pacientes que evitem o excesso de luminosidade, já que a luz faz com que a retina produza metabólitos que não conseguem ser absorvidos por causa da doença. “Assim, eles se acumulam e degeneram a retina. Então, quanto menos luz, menor a quantidade de metabólitos e, portanto, menores são os danos.” Para isso, as pessoas devem usar boné, chapéu e óculos escuros sempre que for possível.
Correção da células
A amaurose congênita de Leber causada por uma mutação no gene RPE65 é o único tipo da distrofia que tem tratamento. Como o Estado de Minas mostrou em 23 de fevereiro, a equipe de médicos liderados pela oftalmologista Jean Bennett, da Universidade da Pensilvânia, corrigiu a alteração genética ao enviar para as células da retina o componente da visão que faltava nelas. Os pesquisadores pegaram o vírus AAAV8 e o modificaram, de modo que ele pudesse transportar o gene completo, sem mutações. Em seguida, o vírus é injetado na retina, por meio de uma cirurgia. Esse vetor, então, insere o gene no núcleo da célula, que vai fazer com que a estrutura produza as proteínas necessárias para o funcionamento adequado da visão.