Um dos assuntos mais básicos (e menos complexos) das aulas de química é a introdução para um universo gigante de elementos, equações, reações e fórmulas: os átomos. A constituição da matéria é algo que intriga o ser humano desde as civilizações mais antigas - filósofos, matemáticos, artistas tentaram entender o que seria a origem de tudo, e alguns deles tiveram ideias bem-sucedidas e aceitadas pelas comunidades científicas.
Vamos falar, então, sobre as principais teorias que explicam as estruturas atômicas. Este é um assunto que, apesar de parecer fácil e simples, sempre se encontra presente nos vestibulares e, claro, no ENEM, e é um tema escorregadio, facilitador de confusões entre as teorias e os teóricos. Por isso, aqui você entenderá quais são cada um desses estudos e saberá quem foi que trouxe a nós cada um deles.
Teoria de Dalton

O estudo de John Dalton (1766-1844), químico, metereologista e físico, foi um dos pioneiros a defender que a matéria é composta por diversas pequenas partículas, e a primeira aceita cientificamente com grande notoriedade.
Os experimentos de Dalton o levaram às seguintes afirmações: os átomos são esféricos, indivisíveis e permanentes, não podendo ser criados nem destruídos, os átomos têm carga elétrica neutra, os átomos de um elemento são iguais em massa e em propriedades químicas, enquanto átomos de elementos diferentes diferem em tais características, as reações químicas são uma reorganização dos átomos, pois átomos de um elemento não se convertem em átomos de outros, e os compostos são formados pela combinação de átomos em proporções diferentes.

A chave para saber a teoria de Dalton é de lembrar que seus estudos indicaram que a estrutura dos átomos é semelhante a uma bola de bilhar ou até a uma bola de gude, compartilhando com sua teoria as características maciças e “duras”.
As principais falhas hoje apontadas por químicos para a teoria de Dalton é a existência de isótopos, a existência do núcleo, dos orbitais e dos níveis de energia, o fato de que átomos podem, sim, ser alterados durante reações, como em sua carga elétrica, ganhando ou perdendo elétrons, além da própria inexistência da menção dos elétrons em sua teoria.
Teoria de Thomson

Ganhador de um Nobel de física em 1906, Joseph John Thomson (1856-1940) criou sua teoria ao realizar experimentos sobre raios catódicos. Seus estudos levaram-no a descobrir a existência da carga elétrica nos átomos, isto é, os elétrons, ao verificar raios que podiam ser interpretados como feixe de partículas com energia elétrica negativa. Isso o levou a estabelecer também a relação carga/massa do elétron, concluindo que constituíam todo tipo de matéria, já que tal relação era a mesma para qualquer gás testado.
Seu modelo hoje é conhecido como pudim de passas ou ameixas, já que reconhece a divisibilidade do átomo e o considera um aglomerado composto de uma parte de partículas positivas pesadas, que são os prótons, e outra de partículas negativas mais leves, os elétrons, as quais se localizam em meio a um “pudim” de partículas positivas. Além disso, por afirmar também que os elétrons estavam distribuídos em anéis que se movimentavam em órbitas em volta da esfera de prótons.
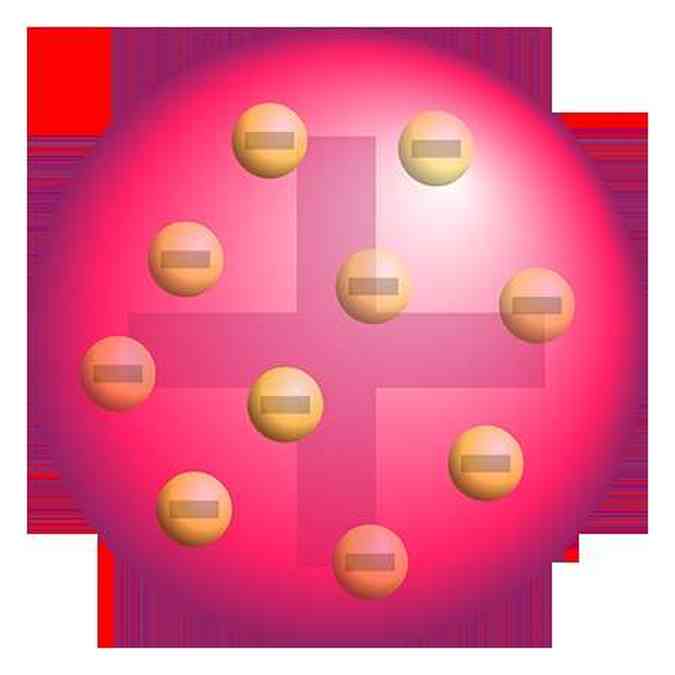
Algumas das falhas apresentadas em seu modelo são, novamente, a ausência do núcleo, dos orbitais e níveis de energia, os elétrons sem energia quantizada e a falta de explicação sobre a estabilidade eletrostática do átomo, já que muitas partículas negativas próximas umas das outras deveria causar uma repulsão.
Teoria de Rutherford

O cientista neozelandês Ernest Rutherford (1871-1937), realizando experimentos com radioatividade, descobriu que o átomo não era uma partícula maciça, como havia afirmado Dalton. Ao lançar partículas %u2C81 positivas a partir do elemento radioativo polônio sobre uma lâmina fina de ouro, Rutherford notou que alguns feixes atravessaram o elemento, enquanto outros poucos sofreram um desvio em seu caminho ou até refletiram.
Este fato foi explicado por ter havido uma repulsão das cargas positivas das partículas %u2C81 com uma região também positiva. Assim, ele concluiu que, dentro do átomo, haveria um grande espaço vazio onde os elétrons se posicionavam (denominada eletrosfera), mas um pequeno e denso núcleo onde se encontravam os prótons - um espaço 10.000 ou 100.000 vezes menor que o próprio átomo.
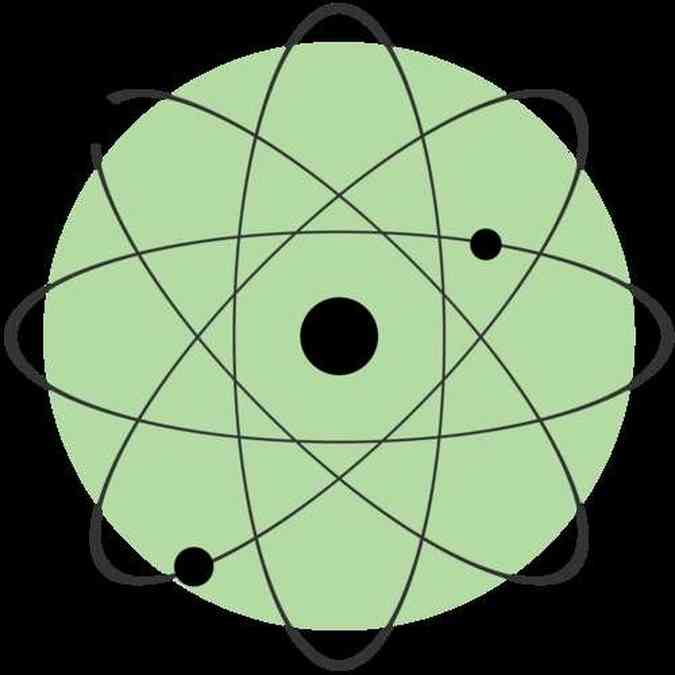
Além disso, o cientista surgiu com a ideia de que os elétrons se movimentavam em trajeto circular ao redor do núcleo, pois, caso estivessem parados, se chocariam com as partículas positivas. Seu modelo ficou conhecido por ser semelhante ao sistema solar. A única falha apontada para a teoria do cientista é a não explicação, novamente, de como o átomo se mantem estável eletricamente.
Teoria de Bohr

Niels Bohr resolveu aperfeiçoar o modelo de estrutura atômica trazido por Rutherford, surgindo daí o modelo conhecido como Rutherford-Bohr. Ele criticou a teoria do cientista pois, de acordo com a física clássica, o átomo não poderia existir de tal forma, já que seus elétrons perderiam energia e cairiam no núcleo. Assim, Bohr sua teoria sobre distribuição e movimentação dos elétrons baseado na teoria quântica proposta por Max Planck.
Ele propôs as seguintes afirmações: os elétrons se movimentam em órbitas circulares ao redor do átomo, chamadas de camadas eletrônicas ou níveis de energia, cada camada permitida possui uma energia diferente, ao receber energia, o elétron pode saltar para uma camada mais energética, o que faria do átomo algo instável, e o elétron pode voltar à sua camada original, mas para isso emitirá energia em forma de luz ou calor.
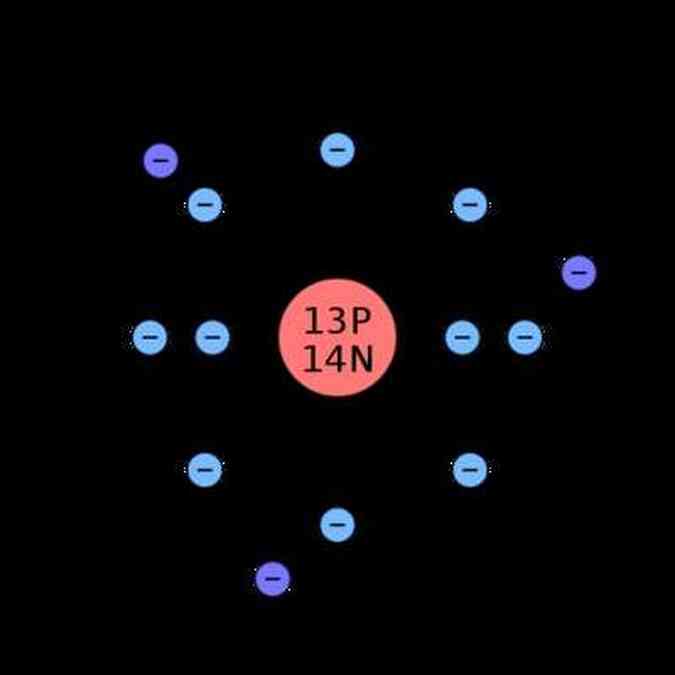
Assim, Bohr criou um modelo baseado na existência de diferentes níveis de energia, sendo que, quanto mais distante do núcleo, maior sua carga elétrica, e dividiu estes níveis em 7 camadas, as quais recebem as letras K, L, M, N, O, P, Q.
Algumas falhas notadas sobre seu modelo correspondem à falta de explicação de por que o elétron possui energia constante e das reações químicas. É interessante adicionar que, em 1932, o cientista James Chadwick descobriu a existência dos nêutrons no átomo.
Texto desenvolvido por Percurso Educacional Pré-Vestibulares e ENEM
